肿瘤微环境(TME)具有精氨酸匮乏的特点,多种肿瘤细胞可以通过表达精氨酸琥珀酸合成酶(Argininosuccinate Synthase, ASS)将瓜氨酸转化为精氨酸,从而抵抗精氨酸饥饿,而T细胞不能表达ASS因此不能耐受精氨酸饥饿。夏梦前期的研究工作从表观和代谢的角度解释了肿瘤细胞和T细胞对于精氨酸匮乏TME的这种不同适应性。并且在研究过程中发现,活化的人CD4+ T细胞可以并仅在一种特殊的低精氨酸条件,即精氨酸浓度接近20μM时,可被诱导表达ASS,提示该条件对于T细胞的命运决定可能具有特殊的病生理意义,基于此我们进一步展开了深入研究。
2024年3月23日,澳门·新葡萄新京6663夏梦/王青青团队联合英国牛津大学程谦博士在Cell Reports发表题为“ATF4-SLC7A11-GSH axis mediates the acquisition of immunosuppressive properties by activated CD4+ T cells in low arginine condition”的论文。本研究聚焦于精氨酸条件改变对T细胞表型和功能的影响,发现低精氨酸条件(20μM)通过ATF4-SLC7A11-GSH轴,赋予T细胞长期活化和Treg样免疫抑制能力,揭示了肿瘤微环境中低精氨酸条件和T细胞免疫抑制性之间的潜在联系,提示该浓度可能是肿瘤免疫治疗需要关注和打破的阈值。

临床肿瘤患者可能存在这样的低精氨酸条件,例如有报道急性髓系白血病患者血浆中的精氨酸水平(20μM左右)低于健康对照组(130μM)。本研究的体外实验结果提示,20μM低精氨酸条件能够刺激CD4+ T细胞在激活早期轻微表达ASS,表明低精氨酸条件可能影响T细胞命运。
低精氨酸条件下长期培养的人CD4+ T细胞表现出活跃的糖酵解和线粒体呼吸,这种持续激活的代谢状态类似调节性T细胞(Treg),同时Foxp3等多个Treg标志物的持续表达和免疫抑制功能实验证明低精氨酸条件赋予人CD4+ T细胞具有Treg样免疫抑制能力。作者利用MC38结直肠癌等多种肿瘤模型进行体内验证,证明TME中的低精氨酸水平与Treg积累和肿瘤生长密切相关。
机制研究揭示,低精氨酸条件能够刺激T细胞高表达SLC7A11,通过促进胞外胱氨酸和胞内谷氨酸的交换,促进胞内GSH的合成,有助于维持胞内氧化还原平衡,应对Treg样特征所导致的ROS积累。低精氨酸条件诱导CD4+ T细胞高表达转录因子ATF4,ATF4在SLC7A11启动子区积累,伴有染色质开放状态,促进SLC7A11基因转录,因此低精氨酸条件通过ATF4-SLC7A11-GSH轴促使CD4+ T细胞保持Foxp3的表达与Treg样功能。
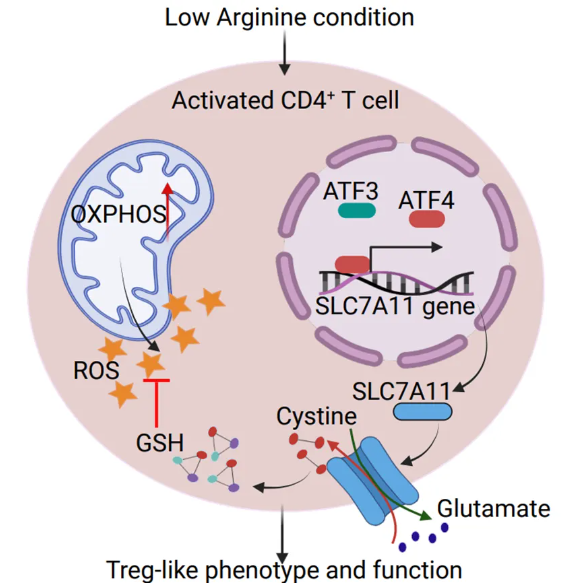
研究机制图
本研究进一步完善了精氨酸可及性对于T细胞可塑性的调控作用,阐明肿瘤微环境中存在的这种特殊低精氨酸条件与免疫抑制性景观形成之间的相关性,为靶向精氨酸代谢的肿瘤免疫疗法提供了更精确的监控指标。
澳门·新葡萄新京6663博士研究生邹梓琪、周嘉洁、郭晨瑶和英国牛津大学程谦博士为本论文的共同第一作者,夏梦副研究员为本论文的主要通讯作者,王青青教授为本论文的共同通讯作者,感谢免疫学研究所王迪教授给予的帮助和指导。










