细胞外囊泡(Extracellular vesicles, EVs)由于携带母体细胞来源的蛋白、核酸、脂质及代谢物等物质,可通过介导不同细胞间的信息交流,参与许多病理、生理过程,包括肿瘤进展、免疫反应、神经系统疾病和心血管疾病等。因此,通过调控EVs的生成可有效调控EVs相关疾病的进展。虽然,已有大量的研究揭示了EVs生成的相关机制,但EVs生成调控的可能性仍处于实验研究阶段,尚未见相关的临床药物可用于靶向EVs生成,从而治疗EVs相关的疾病。EVs被效应细胞摄取,从而向效应细胞内传递相关“货物”,是其发挥功能的先决条件。因此,除了调节 EVs的生成外,还可以通过调节细胞对EVs的摄取影响EVs的功能。通过促进非效应细胞对EVs的摄取,加速细胞外环境中EVs的清除,从而抑制效应细胞对EVs的摄取,有望抑制或终止EVs的功能。
2024年3月27日,澳门·新葡萄新京6663蔡志坚教授/王建莉教授团队在国际胞外囊泡学会官方期刊Journal of Extracellular Vesicles杂志发表题为“Proton pump inhibitors enhance macropinocytosis-mediated extracellular vesicle endocytosis by inducing membrane v-ATPase assembly”的研究论文,揭示了质子泵抑制剂(Proton pump inhibitors,PPIs)通过调节细胞巨吞饮功能,控制细胞外环境中EVs的含量,从而影响EVs的功能及相关疾病的进展。

在筛选抑制细胞分泌EVs的药物时,团队研究人员发现PPIs可以明显减少细胞培养上清中EVs的含量。通过监测细胞对EVs的实时摄取(图1左)及EVs介导的Cre转移产生的细胞荧光转变(图1右),研究人员发现PPIs并不影响EVs的生成,却显著促进了细胞对EVs的摄取,从而导致EVs绝对产量的减少。
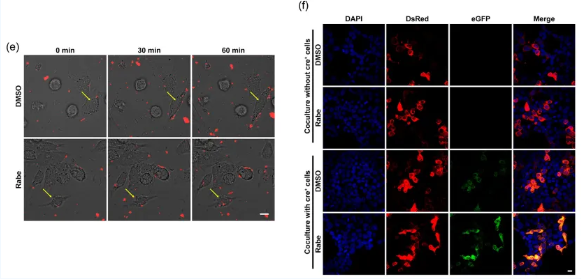
图1 PPIs促进细胞摄取EVs
通过深入的机制研究,研究人员发现,PPIs通过降低胞浆pH值,引起v-ATP酶ATP6V1A亚基从内体膜解离,并定位到质膜,促进质膜v-ATP酶的组装(图2),从而增强细胞的巨吞饮能力,加速细胞对EVs的摄取。
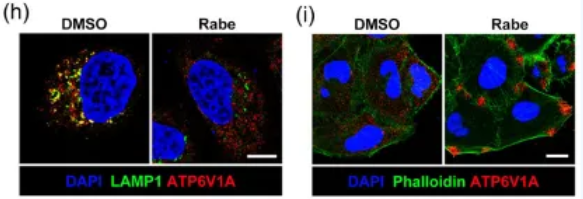
图2 PPIs促进内体ATP6V1A解离及质膜ATP6V1A招募
在此基础上,研究人员试图利用PPIs减少病理性EVs的含量,从而对EVs介导的相关疾病起到治疗作用。肿瘤细胞来源的EVs(Tumor cell-derived EVs, TEVs)可通过介导系统性免疫抑制促进肿瘤的进展。利用小动物活体荧光显微镜和活体成像(图3),研究人员发现PPIs可诱导肿瘤细胞对TEVs的再摄取,从而减少外周循环中的TEVs水平,激活抗肿瘤免疫,抑制肿瘤的进展。
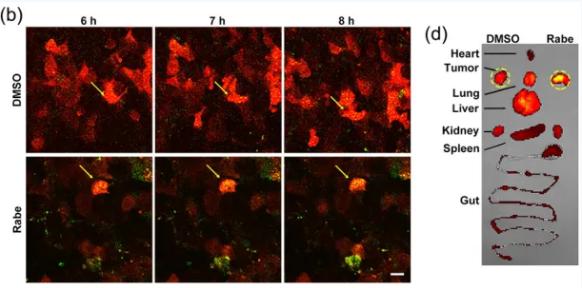
图3 PPIs促进TEVs被肿瘤细胞再摄取
此外,PPIs可提高抗PD-1治疗的敏感性。抗PD-1治疗无效的乳腺癌和黑色素瘤肿瘤小鼠,在联合应用PPIs时,对抗PD-1治疗出现响应。相应的,对临床病人资料的回顾性分析发现,与单独抗PD-1治疗相比,PPIs的联合治疗可明显提高肿瘤病人的无进展生存期。
除参与各种病理、生理进程,EVs还是天然的药物递送载体。由于其天然的细胞来源,与传统的病毒载体相比EVs具有许多独特的优势。比如,EVs具有更的生物兼容性和更低的免疫原性、可穿越血脑屏障、在很大程度上可避免药物的体内降解等。通过促进效应细胞对荷载药物EVs的摄取,有望增强 EVs的递送效率,从而提高载药EVs对相关疾病的治疗效果。因此,PPIs很可能通过提高靶细胞对载药EVs的摄取,提高EVs的递送效率。在随后的研究中,研究人员对这一设想进行了验证。发现PPIs可增强荷载阿霉素和miRNA-155反义寡核苷酸EVs的递送效率,进而提高载药EVs对肿瘤和急性肝损伤的疗效。
综上所述,研究人员发现了PPIs作为一种潜在的调控EVs含量的药物,通过调控细胞对EVs的再摄取,影响EVs介导的功能。
澳门·新葡萄新京6663卢信良博士、浙江省肿瘤医院宋正波主任医师、澳门·新葡萄新京6663郝嘉悦博士和孔祥辉博士为本文的共同第一作者。澳门·新葡萄新京6663蔡志坚教授和王建莉教授为本文的共同通讯作者。










